Nghiên cứu sản xuất mẫu ngoại kiểm huyết thanh học HBsAg và ANTI – HCV
Phạm Thị Hương Trang, PGS.TS. Đặng Thị Ngọc Dung, Nguyễn Trần Phương, Đặng Quang Huy
Theo ước tính của Tổ chức y tế thế giới năm 2015, thế giới có khoảng 240 triệu người nhiễm virus viêm gan B, 130 – 150 triệu người nhiễm HCV mạn tính. Việt Nam là nước thuộc vùng dịch lưu hành rất cao đối với viêm gan B và vùng có tỷ lệ mắc viêm gan C vừa phải. Để thực hiện chức năng , nhiệm vụ của Trung tâm kiểm chuẩn chất lượng xét nghiệm y học trong quản lý, giám sát chất lượng xét nghiệm các phòng xét nghiệm thuộc địa bàn được phân công và thực hiện Quyết định 316/QĐ-316-TTg ngày 27/02/2016 của Thủ tướng Chính phủ, Trung tâm đã triển khai đề tài nghiên cứu cấp cơ sở: “Nghiên cứu sản xuất huyết thanh kiểm tra chất lượng xét nghiệm HBsAg và anti HCV”.
Nghiên cứu được thực hiện từ tháng 1/2017 đến tháng 6/2018 tại Trung tâm Kiểm chuẩn chất lượng xét nghiệm y học và Khoa Kỹ thuật y học – Trường Đại học Y Hà Nội. Các mẫu huyết tương sau khi thu thập được kiểm tra trên thiết bị hóa sinh tự động Cobas 8000 bằng phương pháp điện hóa phát quang. Các mức nồng độ âm tính và dương tính cho mẫu ngoại kiểm Anti – HCV và HBsAg được lựa chọn theo chỉ số ngưỡng (Cut off index – COI). Bộ mẫu được xây dựng cho 3 mức nồng độ ở cả 2 thông số:
– HBsAg: Âm tính (<0,9 COI), dương tính 4-10 COI và dương tính 20-30 COI
– Anti-HCV: Âm tính (<0,9 COI), dương tính 50-60 COI và dương tính 90-100 COI
Mẫu có thể được sản xuất dưới dạng sử dụng sẵn, đông lạnh hặc đông khô. Với ưu điểm độ ổn định, tuổi thọ cao hơn, các yêu cầu về điều kiện vận chuyển dễ dàng hơn nên hiện nay, các nhà sản xuất ưu tiên sản xuất mẫu chuẩn ở dạng đông khô. Nhóm nghiên cứu đã xây dựng quy trình sản xuất chi tiết và tiêu chuẩn cơ sở cho mẫu huyết thanh chuẩn dùng trong nội kiểm tra và ngoại kiểm tra chất lượng cho hai xét nghiệm HbsAg và Anti-HCV trong điều kiện phòng thí nghiệm và đã sản xuất thành công bộ mẫu kiểm tra chất lượng xét nghiệm ở dạng đông khô, thoả mãn các yêu cầu theo ISO 13528 và ISO 17043.
– Độ đồng nhất: Số lượng mẫu tối thiểu cần kiểm tra là 10 mẫu/1 lô. Các lô mẫu đều đảm bảo bộ đồng nhất trước và sau khi thực hiện đông khô (p>0.05).
| Lô mẫu | Giá trị p (HBsAg) | Lô mẫu | Giá trị p (anti – HCV) |
| L0 | 0,1213 | L0 | 0,07079 |
| L1 | 0,3082 | L3 | 0,3003 |
| L2 | 0,842 | L4 | 0,9189 |
– Độ ổn định: Kết quả nghiên cứu cho thấy, ở điều kiện bảo quản 2-8ᵒC, các mẫu ổn định trong 7 tháng và trong 45 tiếng vận chuyển mẫu (từ 12h 25/12/2017 đến 9h 27/12/2017) mẫu vẫn đảm bảo độ ổn định (p>0.05). Sau khi hoàn nguyên, thời gian ổn định của mẫu trong điều kiện bảo quản 2-8ᵒC và -20ᵒC lần lượt là 2 ngày và 7 tuần.
– Kiểm tra bội nhiễm: Mẫu không bị nhiễm khuẩn sau 8 tháng kể từ ngày sản xuất ở điều kiện bảo quản 2 – 8ᵒC.
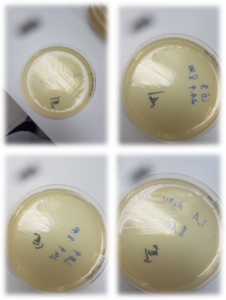
Hình ảnh kiểm tra bội nhiễm của mẫu lô L1-L4 sau 8 tháng kể từ ngày sản xuất
Chương trình ngoại kiểm được thiết kế bước đầu thành công cho 14 phòng xét nghiệm tham gia thử nghiệm, sử dụng các phương pháp và hệ máy phân tích phổ biến trên thị trường. Cụ thể, 100% cá phòng xét nghiệm tham gia thử nghiệm có kết quả phiên giải trùng với kết quả phiên giải của các lô mẫu.
Nghiên cứu trong tương lai sẽ tập trung vào việc thiết kế quy trình sản xuất công nghiệp và thương mại hoá bộ mẫu ngoại kiểm với mục đích đưa vào thị trường, trong đó khắc phục các hạn chế còn tồn tại trong nghiên cứu hiện tại bằng cách bổ sung số lượng mẫu, phòng xét nghiệm tham gia thử nghiệm, và phương pháp thử nghiệm.


